İlaç Sanayisinin Ardındaki Mantığın Sebebi: Proteinlere Dair Bilinmesi Gereken Her Şey

binlerce yıldır insanlar hastalıklara tedavi bulmaya çalışıyor
bu yöntemler modern tıp gelişene kadar çoğunlukla pek işe yaramıyordu. zamanla bilim ilerledi ve hastalıkları tedavi etmek için uyguladığımız yöntemler değişti.
organik kimyadaki gelişmelerle yavaş yavaş sentetik ilaçlar üretmeye başladık. eskiden şans eseri keşfedilen bir kimyasal insanların hastalıklarını iyileştireceği umularak hastalara verilirdi. şundan 150 yıl önce doktorlar bir tedavi yöntemi olarak hastalara civa dahi veriyordu. haliyle bu tür ilaçların hastalarda olumsuz etkileri oluyordu.
günümüzde tıp değişmeye başladı. 1990'larda başlayan ve 2000'lerin başında sonlanan insan genomu projesiyle insan genomunu çözdük. gelişen dna sekanslama yöntemleri sayesinde tam genom analizi 20 yıl önce milyon dolarları bulurken günümüzde 1000 dolara yapılabiliyor.
1970'lerden itibaren tıp alanındaki gelişmeler sayesinde insan biyolojisinin moleküler seviyede nasıl çalıştığını öğrenmeye başladık. bütün bunlar hastalıkların arkasındaki moleküler süreçleri anlamamızı kolaylaştırdı. en büyük etki ise insan genomu projesinin tamamlanmasıyla oldu.
gen, kalıtım yoluyla geçen ve bir canlının oluşturulmasıyla ilgili bilgi taşıyan bir ögedir. genler hücre çekirdeğinde dna olarak taşıdığımız bu veri proteinlerin amino asit dizilimi ilgili bilgi taşır. protein sentezi, genlerin hücre tarafından okunması sonucu gerçekleşir. hücre sürekli dna okumakta dolayısıyla da, bir fabrika gibi sürekli protein sentezi yapmaktadır.
amino asitler, bir kısmını besin yoluyla aldığımız bir kısmını ise vücudumuzun sentezlediği moleküllerdir. amino asitlerin bir araya gelmesiyle polipeptid zinciri oluşur.
dna okunuyor
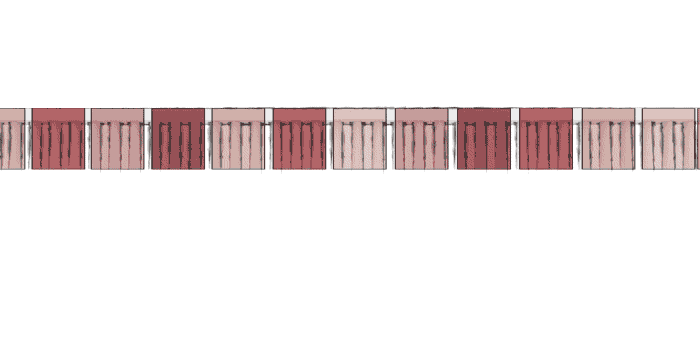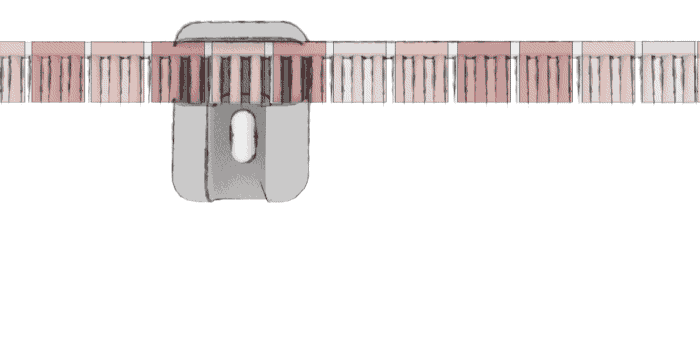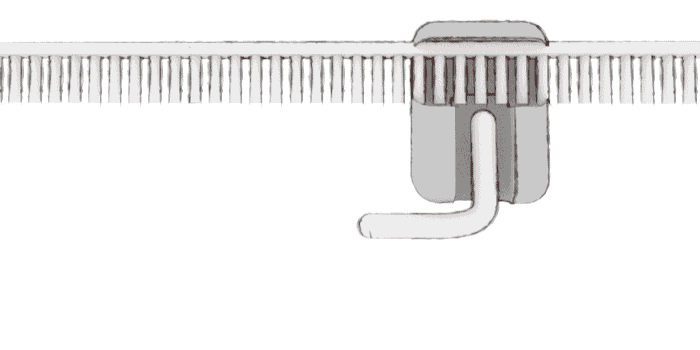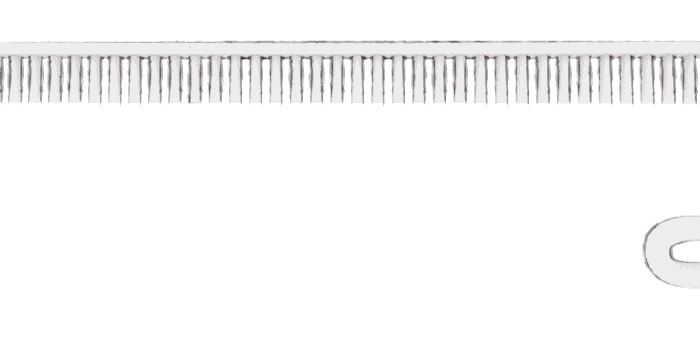
protein sentezleniyor
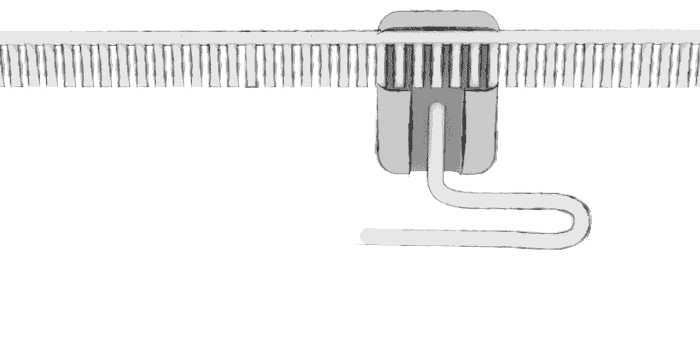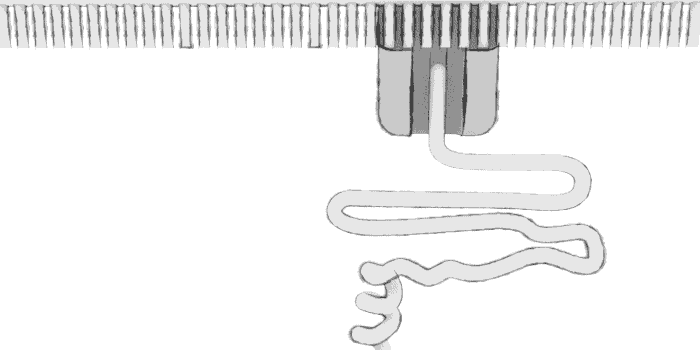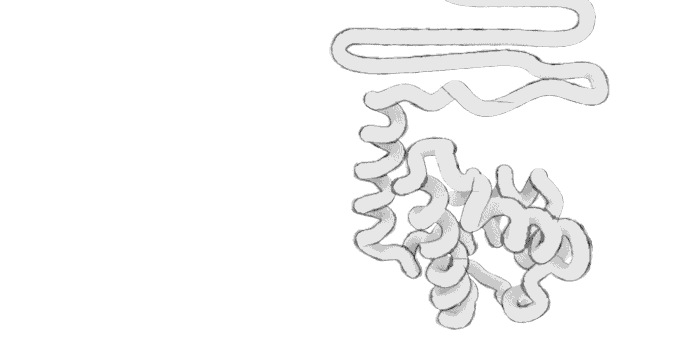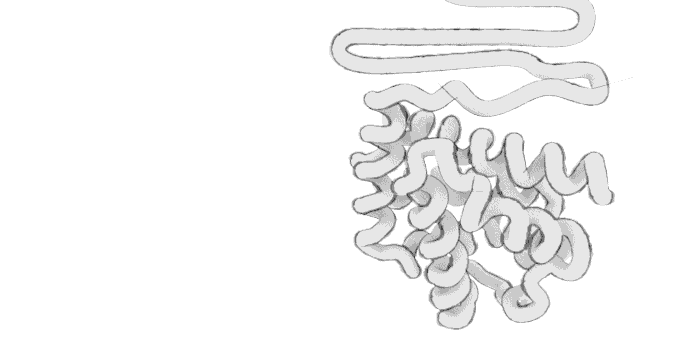
polipeptid zinciri
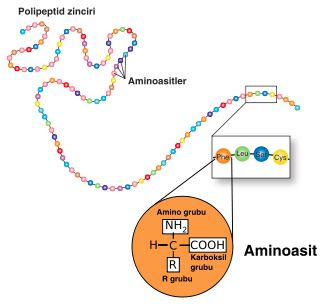
amino asit dizilimleri, moleküler bir zincirdir. amino asitler termodinamik etkileşimler sonucunda katlanarak proteinleri oluşturur. insan vücudunun kullandığı 20 amino asit vardır ve bunları 20 harf ile (veya 3 harfli kodlarıyla) sembolize ederiz.
protein katlanması temsili resmi
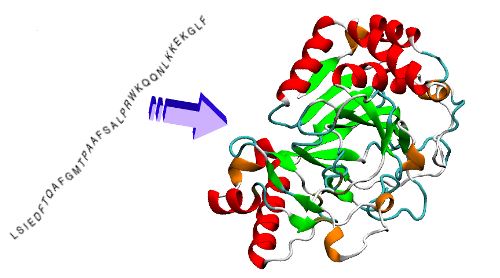
bu amino asit dizilimleri proteinlerin 3 boyutlu yapısını oluşturuyor.
protein katlanması
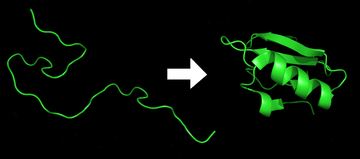
amino asit dizilimlerinin proteinlerin 3-b yapısını oluşturması protein katlanmasıdır. protein katlanması saniyenin çok küçük bir diliminde, termodinamik yasaların, amino asitlerin etkileşimleri ve yardımcı proteinlerin etkisi altında gerçekleşir.
protein katlanması süreci
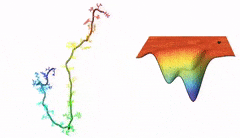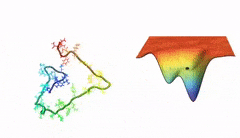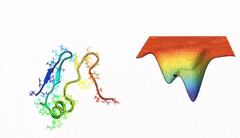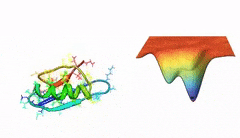
başlangıçta bir polipeptid zinciri var. bu zincir bir katlanarak bir proteine dönüşüyor.
proteinin katlanma sürecini, başka bir deyişle proteinin toplam enerjisinin gittikçe azalarak yerel seviyeye ulaşırken izlediği yolu bir vadi ile illüstre ediyoruz. vadideki ara "çukurlar" proteinin katlanması sırasında sahip olduğu ara enerji seviyeleridir. vadiden yuvarlanan top ise proteinin mevcut enerji seviyesini temsil ediyor. bu enerji seviyeleri, amino asitlerin kendi aralarındaki ve amino asitlerin etrafındaki su molekülleriyle olan etkileşimleri sonucu proteinin sahip olduğu enerjidir. proteinin stabilizasyonu sağlandığında, top vadinin en dibine ulaşıyor, proteinin enerji seviyesi başlangıçtaki seviyenin oldukça altına düşüyor ve katlanma süreci sonlanmış oluyor.
bir protein binlerce atomdan oluşur. her atomun olası bir konformasyonu yani bağlar arasındaki açılardan kaynaklanan belli bir düzeni vardır. her bir konformasyonu göz önünde bulundurursak olası konformasyonların sayısı astronomik rakamlara ulaşır. öyle ki bir proteinin olası her konformasyonu denemek için bir saniyesi bile olsa bu süre evrenin yaşından daha uzun oluyor. bu durumda da proteinlerin belli başlı kurallara göre katlandığını öngördük. hatta birkaç amino asitten ulaşan bir dizilimin dahi bir proteinde bir şekli oluştururken başka bir proteinde tamamıyla farklı bir şekil oluşturması da mümkün. bütün bunlar proteinlerin yapısını bulmamızı zorlaştırıyor.
hücre zarı proteinleri
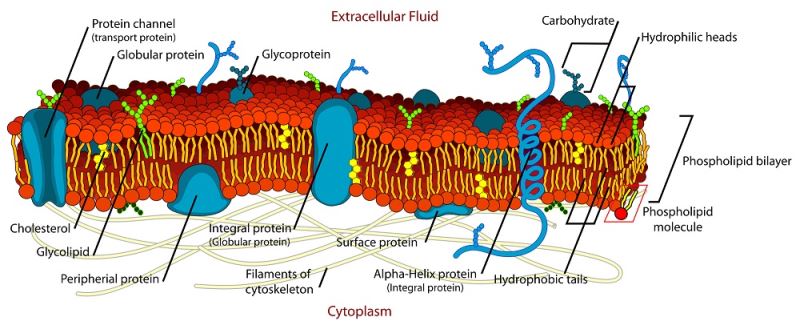
bir protein sentezlendikten sonra proteinin görevi ne ise görevli olduğu bölgeye taşınır. mesela hücre zarı proteini ise hücre zarına gider.
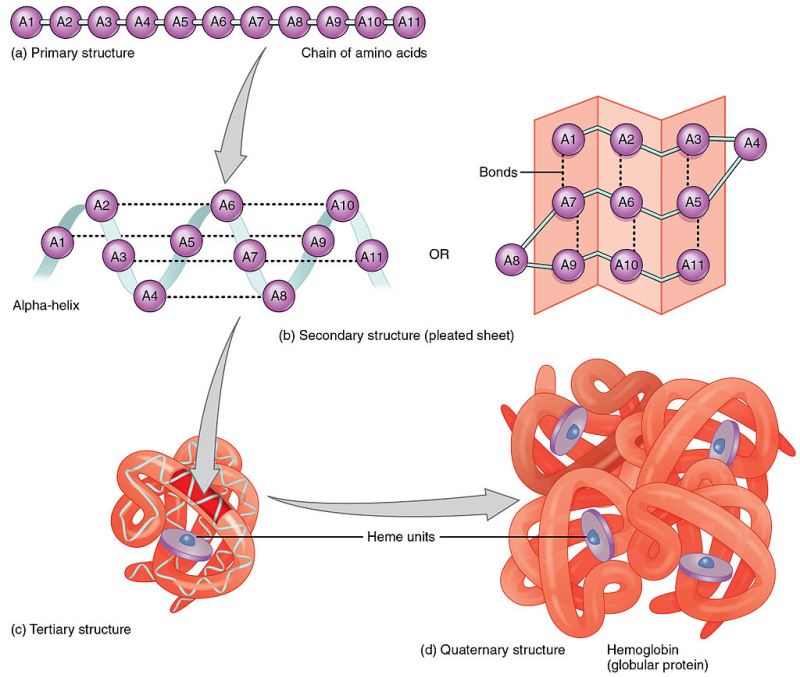
proteinler diğer proteinlerle bir araya gelebilir. aşağıda hemoglobin'i görebilirsiniz. hemoglobin, 2 çift proteinin bir araya gelmesiyle oluşur. proteinlerin bir araya gelmesiyle oluşan komplekslere protein kompleksi denir.
hemoglobinin temsili yapısı
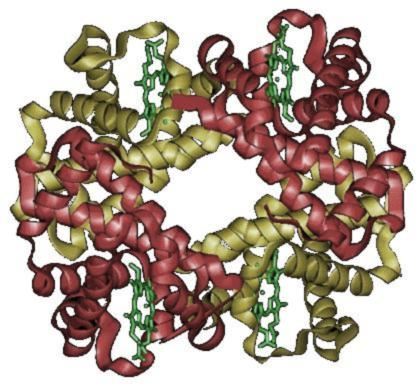
merak edenler olabilir. oksijen'in demire bağlandığı ve kanımızda oksijenin taşınmasını sağlayan kompleks "heme"dir. çizimde gördüğünüz heme dışındaki her yer proteindir. heme bir protein değildir.
hemoglobinin yapısı
buradaki yeşil yapılar da heme.
hemoglobinin yapısı 2
bu gördüğünüz çizimler yalnızca modellemedir. proteinler göremeyeceğimiz kadar küçüktür o yüzden proteinleri bilgisayar ortamında modelleriz. proteinler yüzlerce veya binlerce atomdan oluşan oldukça küçük yapılar oldukları için, onları "görmemizi" veya "anlamlı" bir şekil oluşturmalarını bekleyemeyiz. proteinlerin şekillerini elde etmek için birtakım metodlarımız var. bunlardan daha sonra bahsedeceğim.
proteinlerin hangi amino asitlere sahip olduğunu ve hangi dizilime sahip olduğunu dna sekanslaması yaparak anlayabiliyoruz fakat amino asit diziliminden proteinin 3-b yapısına dair bir çıkarım yapmamız oldukça zordur. bunun sebebi proteinlerin 3-b yapısını yukarıda anlattığım protein katlanması sonucu oluşmasıdır. protein katlanmasının gerçekleşmesini sağlayan termodinamik etkileşimlerin hesaplanması oldukça zordur.
hücre seviyesinde gerçekleşen bazı özel ve tamamıyla normal olan durumlar dışında (örn. ing: alternative splicing veya tr: uçbirleştirme) bir gen her zaman yalnızca bir proteini kodlamak zorundadır. bazı durumlarda ise protein düzgün katlanamayabilir. bu durumlarda protein kullanışsız hale gelebilir veya bir hastalığa sebep olabilir. alerjiler, deli dana hastalığı (prion hastalığı), nörodejeneratif hastalıklar (alzheimer, huntington's, palizeus-merzbacher gibi) yanlış katlanmış proteinlerden kaynaklanır. yanlış katlanım dışında mutasyonlar da hastalıklara sebep olabilir. rahmetli hawking'in hastalığı amniyotrofik lateral skleroz'un bir sebebi sod1 enziminin bir mutasyon sonucunda motor nöronlarda görevini düzgün yapamamasıdır. hatta orak hücreli aneminin sebebi yalnızca bir amino asidin farklı olması sonucu proteinin yapısının değişmesidir.
genetik hastalıkların sebebi proteinlerde gerçekleşen mutasyonlardır. bu mutasyonlar proteinlerin 3-b yapısında birtakım bozukluklara sebep olabilir. dolayısıyla hastalıkların birçok sebebi olabilir. proteinlerin 3-b yapısındaki mutasyonlara bağlı değişimler veya iki proteinin birbiriyle düzgün etkileşime girememesi sonucu hasta olabilirsiniz. hepimiz genlerimizin aynı varyantlarını taşımadığımız için, proteinlerimizin de varyantları farklı oluyor, bu yüzden de farklı hastalıklara sahip oluyoruz.
vücudumuzdaki proteinlerin birçok fonksiyonu olabilir
mesela proteinler reseptör olabilir. örneğin beynimizdeki nöronlardaki reseptörler, iyonların akışını kontrol eder. bu iyonların akışı sonucu oluşan aksiyon potansiyelleri ve nöronların arasındaki iletişim hiyerarşisi, algılarımızı, duygularımızı, duyularımızı ve düşüncelerimizi oluşturur. reseptörlerin sayısı, reseptörün sentezi esnasında gerçekleşen bir değişim, reseptörün hangi varyantına sahip olduğunuz veya bu reseptörde bir mutasyon olması sizi bir psikiyatrik hastalığa daha yatkın hale getirebilir.
androjen receptörü
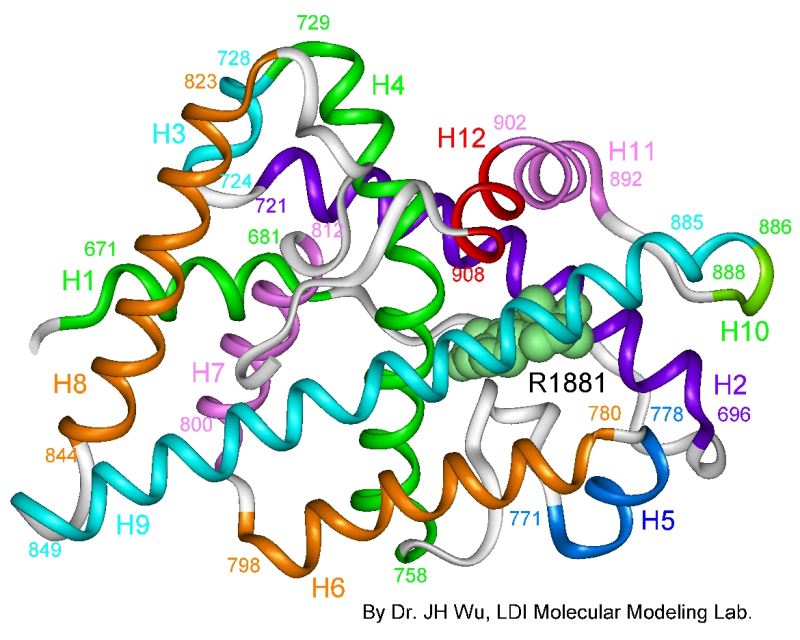
yukarıdaki örnekten bağımsız olarak, hücre içindeki bazı reseptörler belli başlı genlerin aktivasyonunu yani dolaylı yoldan diğer proteinlerin sentezini yönetebilir. bu reseptörlerdeki bir mutasyon da başka proteinlerin sentezinin gerçekleşmesini engelleyebilir. bunlardan biri androjen reseptöründeki bir mutasyonun, testesteronun bağlanamamasına sebep oluşu sonucunda interseks bireylere sebep olduğu androjen insensitivitesi'dir.
kinesin motor proteini, kendisi gibi proteinlerden oluşan mikrotübüllerin üzerinde hareket ederek hücre içinde nakliyat yapar.
kinesin motor proteini kargo taşıyor
kinesin motor proteini

burada da atp-sentaz'ı görüyoruz. bu proteinin amacı ise hidrojen pompası görevi görerek, hücre içi ph seviyesini kontrol etmek.
atp sentaz
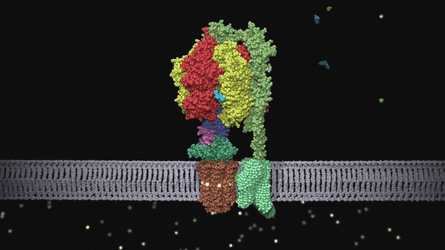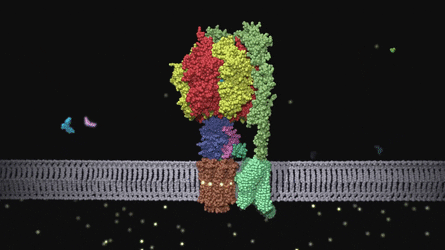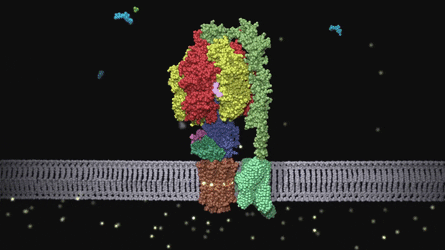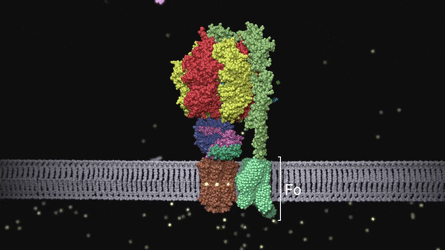
bakteriyel flagellum

bakteriyel flagellum

bakteriyel fragellum ise bazı bakterilerin yüzmesini sağlıyor.
proteinlerin fonksiyonunu öğrenebilmek için proteinlerin yapısını bilmemiz gerekiyor
proteinlerin yapılarını çözmek için x-ışını kristalografisi ve nmr gibi yöntemler var. x-ışını kristalografi metodunda proteinlerin kristalleştirilmiş örneklerine x ışınları gönderiliyor. bu ışınların oluşturduğu dağılımlar elektron haritalandırmaları ve bazı matematiksel hesaplamalar sayesinde bulunıyor. proteinlerin 3-b yapısını modellemek her ne kadar kulağa kolay gelse de, bu oldukça meşakkatli bir iştir. bu yüzden her proteinin 3-b yapısını henüz keşfedemedik. bunun yanı sıra, tamamıyla bilgisayarları kullandığımız yöntemlerimiz de var. bunların gelişmesiyle beraber tahminimce 10 yıl sonra protein katlanması bilmecesini çözmüş olacağız.
proteinlerin 3-b yapısını çözümlemek ve proteinlerin fonksiyonlarını keşfetmek hastalıkların iyileştirilmesinde oldukça önemli bir rol oynuyor.
kanserde, kanserli hücrelerden örnek alınıp bunların dna'sı çözümleniyor. dna'ya bakarak kanser hücresinde hangi protein varyantının bulunduğunu tespit edip bu proteine yönelik etkili olduğu bilinen ilaçlar hastaya verilebiliyor.
proteine yönelik etkili bir ilaç bilinmiyorsa ve protein popülasyon içinde sık rastlanan bir varyant ise ilaç şirketleri bu proteine yönelik ilaç tasarlanması için yatırım yapabiliyor. bunu başarabilmek için proteinin 3-b yapısını bilmemiz gerekiyor.
proteinlere bağlanan (etkileşime giren) moleküllere ligand denir. ligandlar vücudun salgıladığı bir molekül (örn. hormonlar, nörotransmitterler) olabileceği gibi aynı zamanda bir ilaç da olabilir.
aşağıdaki çizimde nöronlarda bulunan potasyum kanalıyla etkileşime giren bir ligand görüyoruz. ligandımız nörotransmitter asetilkolin (kırmızı üçgen) kanal ile etkileşime girerek, kanalın açılmasını sağlıyor.
potasyum kanalı
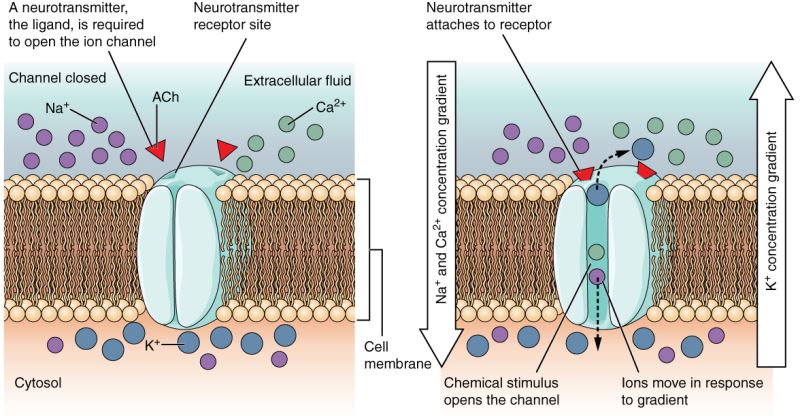
proteinlerin yapılarını çözümlersek bu proteinlerin ligandlarla ne tür etkileşimlere girdiğini de anlayabiliriz. bu sayede hücre içinde neler olduğuna dair bir fikir elde edebileceğimiz gibi aynı zamanda hedef proteine yönelik ilaç da geliştirebiliriz.
yukarıdaki çizimden bağımsız olarak, örneğin ssri tipi (selektif serotonin geri alım inhibitörü) anti depresanlar beyindeki belli başlı proteinlere bağlanan ligandlardır. bunlar reseptörlerle veya kanallarla etkileşime girer. ssri'lar, nörotransmitterlerin geri alınımını inhibe ederler (engeller). bu da serotonin geri alımını inhibe ederek, sizi daha mutlu bir kişi yapar ve depresyonunuzu iyileştirir.
bir ilaç hedef proteine bağlandığı zaman istenen sonucu alırsanız (hasta iyileşirse veya septomlar baskılanırsa) başarılı bir ilaç tasarlamış olduğunuzu söyleyebilirsiniz.
maalesef hayat moleküler seviyede o kadar da basit değil. bir ilaç istemediğimiz bir proteinle etkileşime girerse ve etkileşim hastanın zararına olursa buna yan etki deriz. ilaç şirketleri ilaçlarının istenmeyen proteinlerle etkileşime girerek yan etkilere sebep olmasını istemezler. bu yüzden şirketler ve araştırmacılar seçici ilaçlar geliştirmeye çalışır. eski metodlarla bunu başarmak oldukça zordur. bu yüzden proteinlerin yapılarını çözerek daha iyi ilaçlar geliştirmeliyiz.
binlerce gen var, milyarlarca insan var dolayısıyla da bir hayli fazla olası gen kombinasyonu var. bütün bunlara rağmen bir hastalığı tedavi etmesi için piyasa sürülen yalnızca bir iki ilaç oluyor. bunun sonuçlarını da istenmeyen yan etkiler olarak görüyoruz.
herkes kendi içinde özelken biz herkesi aynıymış gibi kabul edip insanlara aynı ilaçları veriyoruz. bir hastalığı iyileştirmeye çalışırken diğer hastalıkların ortaya çıkışına istemeden de olsa sebep oluyoruz. ilaç şirketleri yavaş yavaş buradaki mantık hatasını fark edip yöntemlerini değiştirmeye başladı.
bütün bu sorunların çözümü kişiye özel ilaç geliştirmek olacaktır
bunu ise proteinlerin 3-b yapısını çözümleyip, hedef proteine yönelik ilaç tasarlamak ve bu ilacın olabildiği kadar spesifik (seçici) olmasını, yalnızca hedef proteine bağlanmasını sağlayarak başarabiliriz.
her ne kadar proteinlerin yapısı önemli olsa da x-ray'den elde ettiğimiz protein modelleri kristallografik olduğu için katıdır yani hareketsizdir. hücre içindeki proteinler normal şartlar altında temel yapılarını koruyarak kendi çapında kıpırdamaktadır. bu hareketleri atp-sentaz'da ve flagellum'da gördük. bu hareketlerin de ilaç tasarlanmasında ve ilaç etkileşiminde önemi olabilir. o yüzden gelecekte protein katlanmasını çözdükten sonra proteinlerin vücut içindeki hareketinin simülasyonlarını da yapmaya çalışarak da ilaç geliştirerek, onları daha etkili veya daha seçici yapmaya çalışabiliriz.
proteinlerin 3-b yapısını anladıkça yalnızca genetik hastalıklara değil aynı zamanda enfeksiyonları da iyileştirebiliriz. bakterilerin üremesini sağlayan proteinlere bağlanan ilaçlar geliştirerek, üremelerini engelleyebiliriz. kulağa çok uçuk gelse de, protein mühendisliğinde bilgisayar ortamında sıfırdan protein üreterek amaca yönelik protein de tasarlanması yönünde çalışmalar da var. bu gen mühendisliğinden farklı bir araştırma konusu çünkü gen mühendisliğinde bir türden farklı bir türe gen (protein) aktarımı yapılır. burada ise biz kendi yaratıcılığımızı kullanarak sırfırdan bir protein üretmiş oluyoruz.
proteinlerin yapısını kullanarak kanser gibi hastalıklara yönelik tedaviler ve ilaçlar da geliştirebiliriz.
ek olarak yrd. doç. dr. david goodsell'e ait birkaç proteinin sulu boya resmini paylaşmadan edemeyeceğim